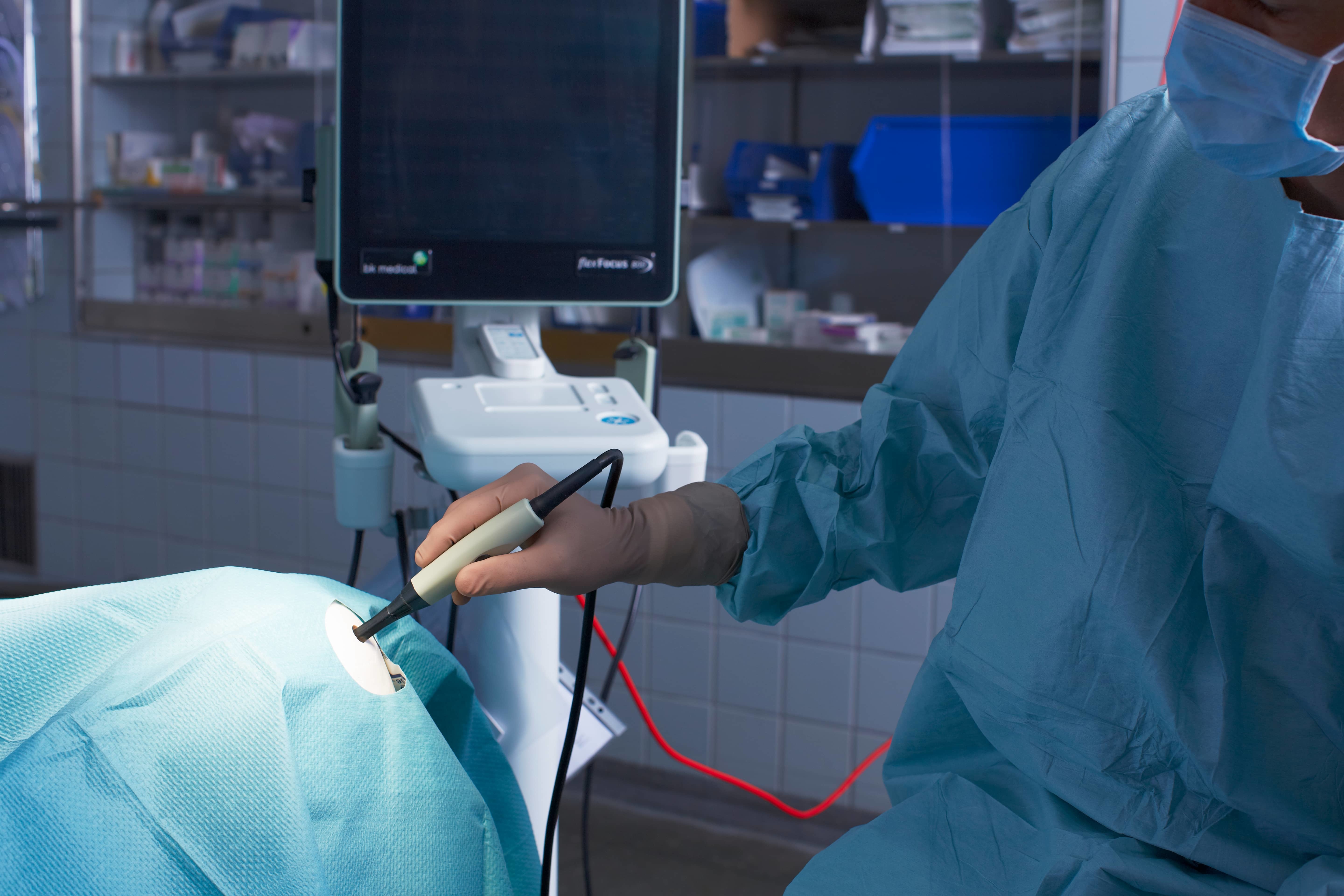
Интраоперационное ультразвуковое исследование, история и практические аспекты
Автор: Ветшева Н.Н. - д.м.н., заведующая отделением ультразвуковой диагностики ГБУЗ МО «Московский областной научно-исследовательский клинический институт им. М.Ф. Владимирского» (Московская область, РФ), главный научный сотрудник ГБУЗ «Научно-практический клинический центр диагностики и телемедицины Департамента Здравоохранения города Москвы» (Москва, РФ).
Ультразвуковое исследование является самым часто используемым неинвазивным методом диагностики, которое позволяет получить наиболее полную информацию о состоянии органов непосредственно во время операции.
Впервые ультразвуковое исследование в условиях операционной было проведено уже в 50-е гг. прошлого столетия [1]. Начали использовать простой А-режим для поиска конкрементов в желчных протоках и почках [2, 3]. Появление двухмерного серошкального В-режима позволило в 70-х гг. расширить границы применения метода и использовать интраоперационное ультразвуковое исследование (ИОУЗИ) для поиска очаговых образований печени и головного мозга [4,5]. С 80-х гг., благодаря усовершенствованию аппаратуры и внедрению в общую клиническую практику режима цветового допплеровского картирования (ЦДК) методику стали активно применять в эндокринной хирургии, панкреатологии, ангио- и кардиохирургии [6-9]. Развитие технического прогресса открыло новые возможности для модернизации оборудования, появились специализированные лапароскопические датчики для ИОУЗИ [10] .
В XXI веке ультразвуковой метод уже стал рутинным и используется в качестве повседневного исследования во всех сферах хирургии. Однако, не смотря на доказанную эффективность и простоту применения, ИОУЗИ рутинно в нашей стране проводят далеко не во всех хирургических стационарах. Целью данного обзора является аккумуляция опыта проведения интраоперационного ультразвукового исследования в иностранной и отечественной литературе с целью популяризации методики и активного его внедрения в ежедневную практику.
Оборудования для проведения ИОУЗИ
Ещё 20-25 лет назад ИОУЗИ выполняли только на стационарных массивных сканерах. В настоящее время появились специальные портативные ультразвуковые приборы, обладающие основными характеристиками для удобства их использования в условиях операционной: компактность, мобильность, возможность работы во всех режимах (В-режим, ЦДК,ЭДК, спектральный анализ кровотока).
Но основное внимание стоит уделять именно выбору датчиков для проведения ИОУЗИ. В зависимости от конкретных задач исследования выбирается форма и площадь рабочей поверхности. Основные формы интраоперационных датчиков, которые используют при открытой хирургии: L-образные, T-образные и I-образные. Чем они отличаются? Возьмем L-образный датчик в виде клюшки, им удобно исследовать открытые поверхности, например, поджелудочную железу, ткани легкого, но осмотреть поддиафрагмальные поверхности печени на предмет наличия метастатического поражения будет затруднительно. Для этих целей удобнее использовать T- или I-образные датчики.

При этом сама сканирующая поверхность может быть как линейной (ровной), так и конвексной (выпуклой над основной поверхностью). Какая удобнее? Безусловно, конвексные датчики при равных формах и размерах сканирующих поверхностей дают больший угол обзора, чем линейные, что значительно сокращает время осмотра.
Одним из основных требований является частота сканирования, которая должна быть обратно пропорциональна глубине зоны интереса. Чем выше частота сканирования, тем более поверхностные структуры можно детально осмотреть. При низкой частоте сканирования хорошо видны глубоко расположенные ткани, а то, что находится непосредственно под датчиком, будет визуализироваться хуже. Так как датчик устанавливается непосредственно на ткань органа, частота сканирования должна быть выше 10-12 МГц. Тогда как при исследовании более глубоких структур требуется снизить частоту сканирования до 8-10 МГц. На обычных стационарных приборах такой частотой обладают линейные датчики для осмотра поверхностно расположенных органов, поэтому на открытых операциях можно использовать их в качестве альтернативы, при отсутствии специализированных, чтобы отработать методику, оценить удобство и необходимость ИОУЗИ, определиться с показаниями.
Не менее важной характеристикой является возможность дезинфекции и обработки датчиков. Для соблюдения правил стерилизации в условия операционной датчики для ИОУЗИ должны иметь возможность стерилизовать полностью. Наиболее распространенный способ – полное погружение датчиков в дезинфицирующий раствор с последующей стерилизацией. Также допускается выполнение исследований нестерильным датчиком, помещенным либо в специальный стерильный пластиковый пакет, либо в стерильную перчатку и чехол.
Методика выполнения ИОУЗИ
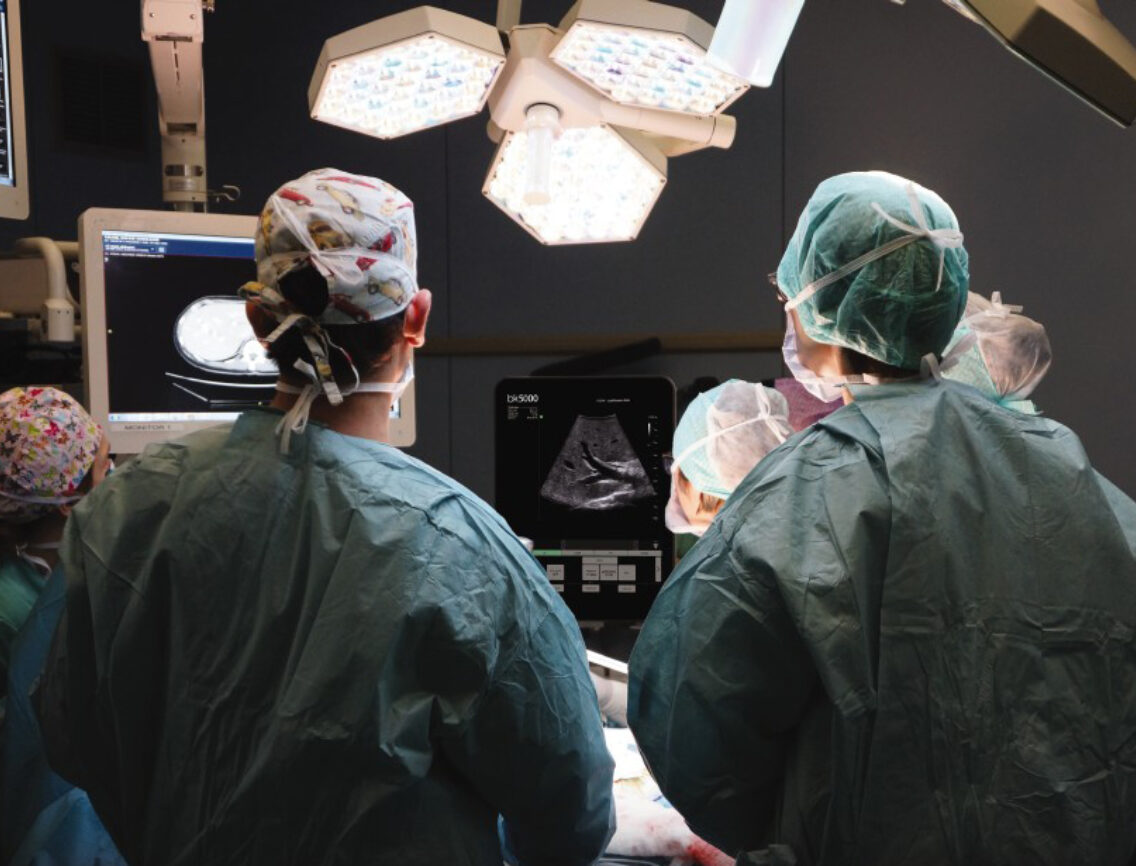
Кто же проводит ИОУЗИ? Исследование может выполнять врач ультразвуковой диагностики, который хорошо ориентируется в ультразвуковой анатомии и владеет нюансами осмотра, тогда можно получить детальную оценку области интереса за меньшее время, но оперирующему хирургу нужно будет объяснить, где и как расположены выявленные изменения. Или датчик может держать сам хирург, а врач ультразвуковой диагностики интерпретировать полученные изображения. При работе в таком тандеме появляется возможность сравнивать тактильные и визуальные ощущения хирурга с результатами инструментального исследования, что, безусловно, улучшает качество ориентации в зоне операции. Многие авторы подчеркивают необходимость интерпретации ИОУЗИ именно опытным специалистом [11].
Сложности в выведении на экран интересующих объектов легко нивелируются путем обучения оперирующих хирургов методике ИОУЗИ, включающими основные принципы – последовательность, полипозиционность и методичность осмотра. Задача врача ультразвуковой диагностики не только полноценно использовать режимы настройки и функциональные возможности прибора, но и объяснить как, куда, под каким углом поставить датчик, а так же в какую сторону, с какой скоростью его перемещать, процедура должна проводиться опытным оператором.
Примеры клинического применения ИОУЗИ в различных сферах хирургии
Нейрохирургия
Основная цель хирургического лечения злокачественных опухолей головного мозга - радикальная резекция опухоли при сохранении окружающей функциональной ткани мозга, что напрямую связано с увеличением продолжительности и улучшением качества жизни пациента [12]. Рамочные и безрамочные стереотаксические предоперационные нейронавигационные системы, обычно используются, чтобы помочь хирургам спланировать место краниотомии и идентифицировать критические нервные структуры. К сожалению, эти системы имеют проблемы, связанные с потерей точности в результате искажения, сдвига и деформации после краниотомии и удаления ткани опухоли [13]. В последнее время разработаны новые методы, включая интраоперационную диагностическую визуализацию (Intra-Operative Magnetic resonans) дороги и доступны не во всех нейрохирургический центр. Поэтому большое внимание уделяется возможностям интраоперационного использования УЗИ.
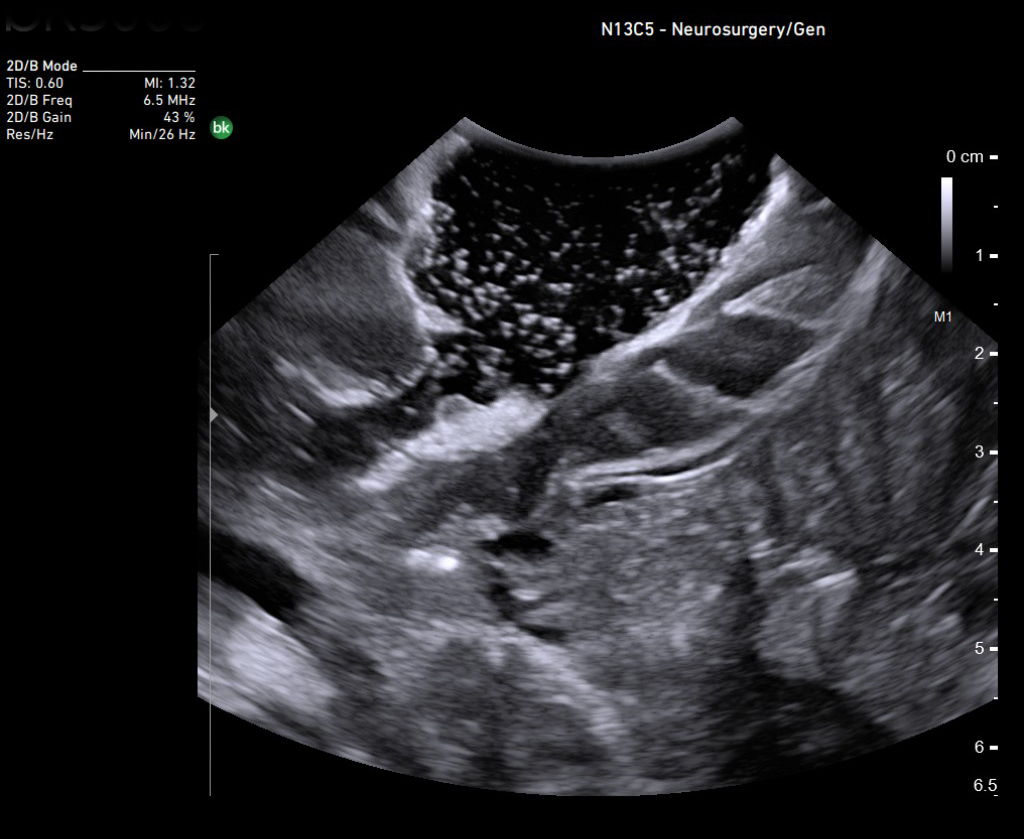
ИОУЗИ помогает локализовать опухоль, определить ее границы, а также провести осмотр зоны после удаления на предмет наличия остаточной опухолевой ткани и оценки радикальности выполненного вмешательства [14,15]. Его основными ограничениями являются пространственное разрешение, ширина и ориентация поля зрения (разные от стандартных ортогональных плоскостей КТ и МРТ) и качества сканирования, которые зависят от оператора.
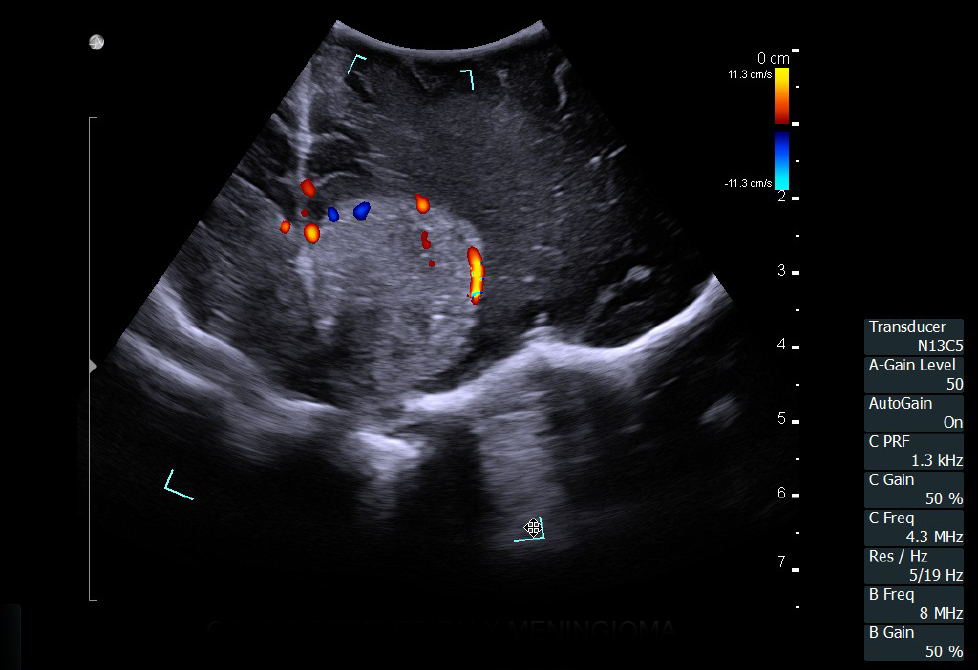
Отечественные и зарубежные авторы доказали высокий уровень корреляции между данными, полученными при интраоперационном УЗИ и послеоперационной МРТ с контрастным усилением при обнаружении остаточной опухолевой ткани [16,17]. При этом применение режимов допплерографии, а также контрастного усиления значимо повышают информативность исследования. Цветовое допплеровское картирование при сосудистых аномалия позволяет не только локализовать аневризму, но и вместе со спектральной допплерографией провести оценку гемодинамических показателей, например, после клипирования аневризмы.
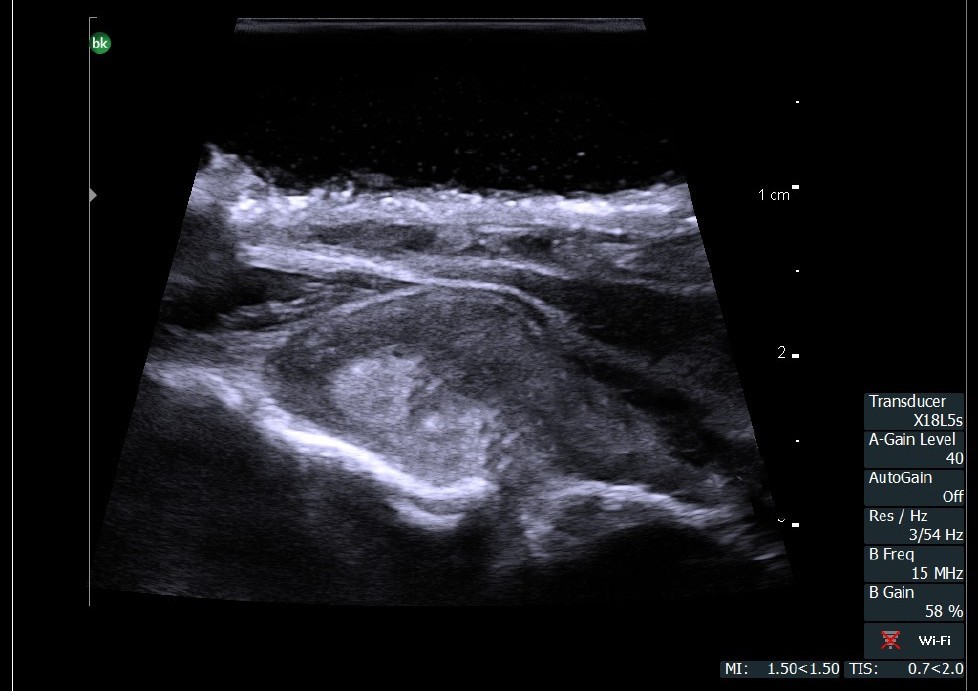
Торакальная хирургия
Но может ли быть полезно и информативно ИОУЗИ при операциях на легких, особенно торакоскопических? Да, и есть несколько вариантов применения методики.
Если задача торакоскопического ИОУЗИ легкого найти небольшое периферическое образование, расположенное на глубине 1-2 мм от париетальной плевры, чтобы минимизировать объем операции, достаточно осмотреть поверхность легкого в зоне интереса, которая до операции обозначена на КТ. Изображение солидных образований на фоне воздушной легочной ткани имеет свои особенности практически анэхогенные чаще аваскулярные.
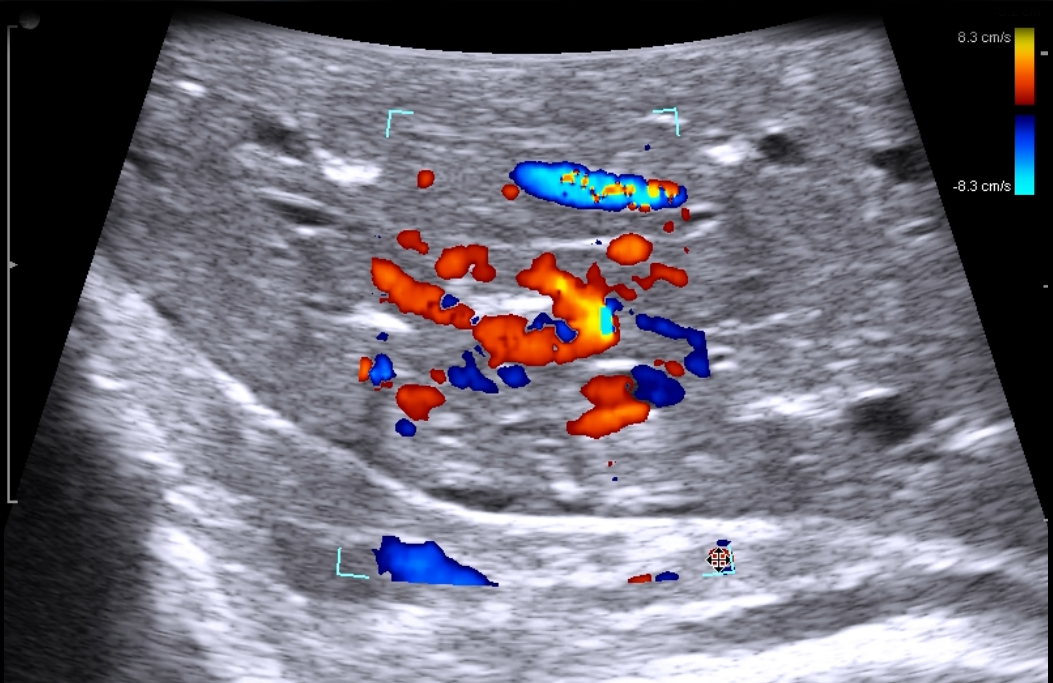
Легочный коллапс является важным фактором локализации образований, которые располагаются в центральных отделах легких, низкое давление и низкий поток CO2 в грудную клетку является безопасным способом вызвать коллапс легкого [18]. Во многих исследованиях приведены информативность ИОУЗИ в поисках образований легкого, которая по мнению разных авторов находится в пределах 93-97% [19]. По результатам, время интраоперационной ультразвуковой локализации было значительно короче, чем при пальпации (7,09 1,80 минут 9,67 2,62 минут: P <0,05). Также подчеркивается необходимость участия в интерпретации результатов ИОУЗИ опытно специалиста по ультразвуковой диагностики.
Отечественными авторами предлагается для детальной оценки, в случаях глубокого расположения патологического очага или его локализации вблизи легочной артерии, легочной вены, их крупных ветвей, бронхов крупного калибра пациента переводить на искусственную вентиляцию одного легкого, исследуемое легкое при этом выключалось из дыхания, коллабировалось и проводилось УЗИ-исследование. Перед началом исследования в один из торакопортов наливали теплый стандартный, стерильный физиологический раствор (NaCL) в количестве 800-1200 мл до полного покрытия поверхности исследуемого легкого жидкостью шириной 3-5 мм для улучшения контакта датчика с поверхностью органа [20].
Абдомиальная хирургия
Среди всех интраоперационных исследований основная доля приходится на ИОУЗИ печени. Главная задача – это выявление мелких непальпируемых вторичных образований до 1,0 см, которые трудно диагностируются на дооперационном этапе. Следует обращать внимание на любые изменения структуры и эхогенности паренхимы печени, т.к. картина метастатического поражения полиморфна и разнообразна в зависимости от первичного очага. Наиболее часто небольшие метастазы представляют собой гипо- или изоэхогенные округлые структуры, окруженные гипоэхогенных ободком, аваскулярные в режиме ЦДК. При осмотре крупных очагов оценивают их границы и взаимоотношение с крупными сосудистыми структурами [21]. Оценка границ поражения наиболее актуальна при операциях по поводу алвеококкоза, когда вероятность послеоперационного рецидива обратно пропорциональная радикальности выполненного вмешательства.
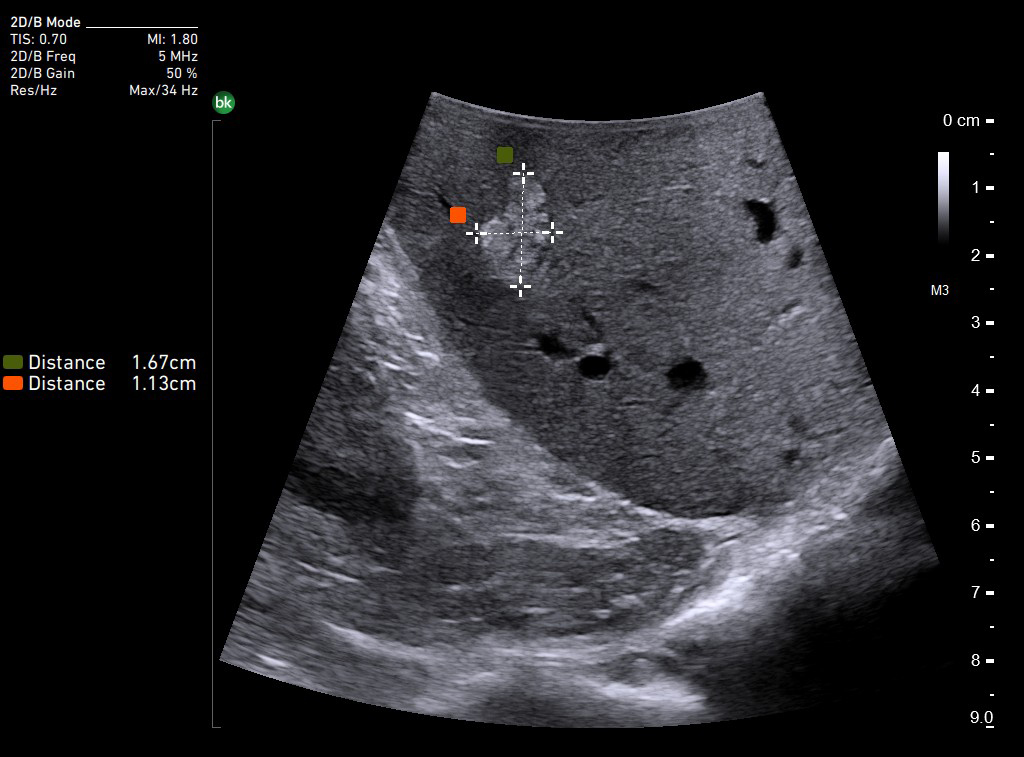
В панкреатологии ИОУЗИ применяют как при доброкачественных процессах, например, при хронических панкреатитах для локализации главного панкреатического протока, выявления вирсунголитиаза, поиска псевдокист в паренхиме поджелудочной железы и стенке двенадцатиперстной кишки, недоступных визуальному осмотру, так и при злокачественном поражении. Наиболее сложным является оценка измененной ткани головки поджелудочной железы с целью дифференциальной диагностики псевдотуморозного панкреатита и рака.
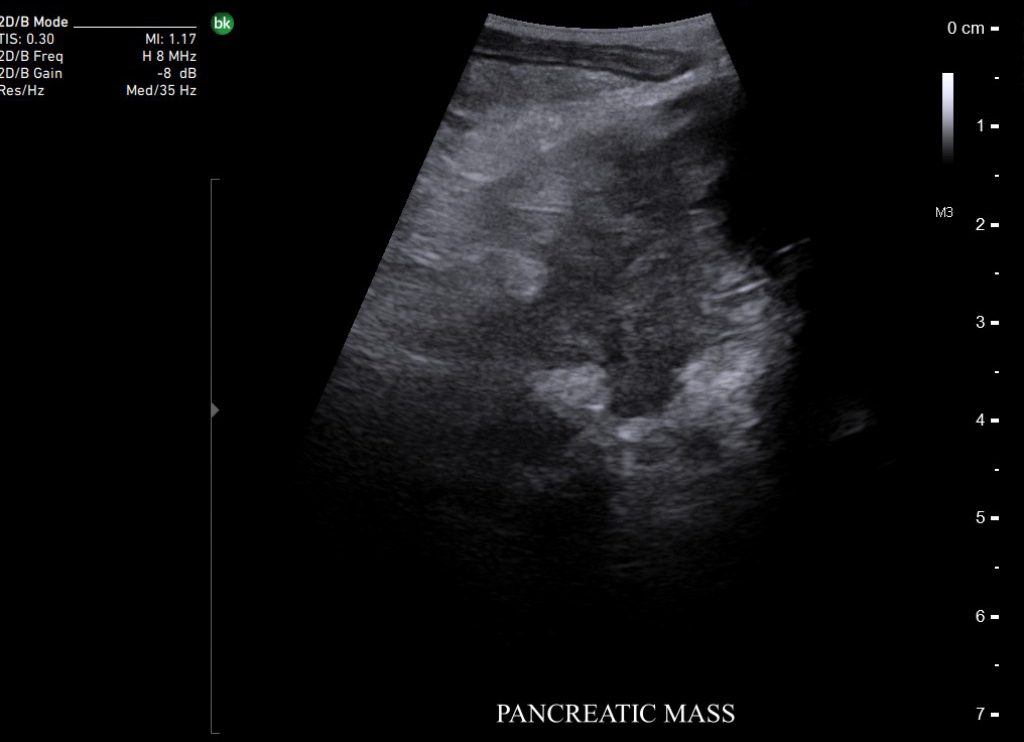
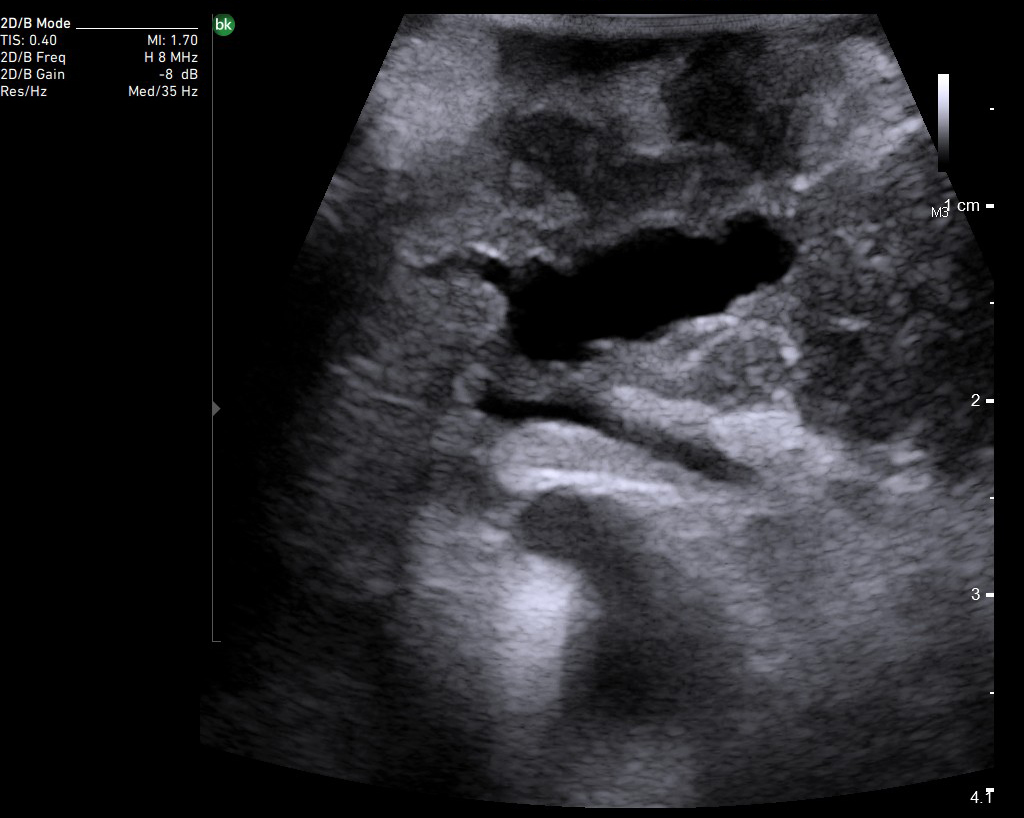
При злокачественных поражениях поджелудочной железы по данным ИОУЗИ проводят окончательную оценку резектабельности и операбельности образований [22]. Взаимоотношение опухоли с окружающими сосудистыми структурами выполняют в продольной и поперечной плоскости сканирования относительно оси сосуда. В первом случае оценивают протяженность контакта и измеряют спектральные характеристики кровотока, во втором – проходимость просвета сосуда и площадь контакта образования с окружностью. По последнему критерию разделяют резектабельные опухоли, когда площадь контакта составляет менее 25% (90º) окружности, условно-резектабельные – опухоль охватывает 25-75% (90º-270º) окружности, нерезектабельные циркулярное вовлечение сосуда более 75% (270º) окружности [23].
ИОУЗИ нейроэндокринных опухолей поджелудочной железы после пальпации является «золотым стандартом» в хирургии данного вида образований [24]. Если при ультразвуковом исследовании не удается четко выявить наличие гипоэхогенной гиперваскулярной опухоли с четкими контурами, которая интенсивно копит контраст в раннюю артериальную фазу, то можно высказать предположение о наличии незидиобластоза [25].
Ультразвуковое исследование селезенки проводят наиболее часто при паразитарных поражениях других органов для исключения наличия мелких эхиноккоковых кист, во время операций с перевязкой селезеночных сосудов, для оценки кровоснабжения паренхимы [26].
Важным моментом является интраоперационный осмотр зон лимфоотока. Лимфатические узлы брюшной полости могут претерпеть изменения как при воспалительных заболеваниях, так и при метастатическом поражении [27,28]. Интраоперационное исследование лимфатических узлов с целью дифференциальной диагностики изменений в узлах проводят во всех областях хирургии [29]. ИОУЗИ позволяет с высокой достоверностью говорить о наличие лимфаденопатии, однако четко определить характер поражения по данным ультразвукового исследования не всегда возможно.
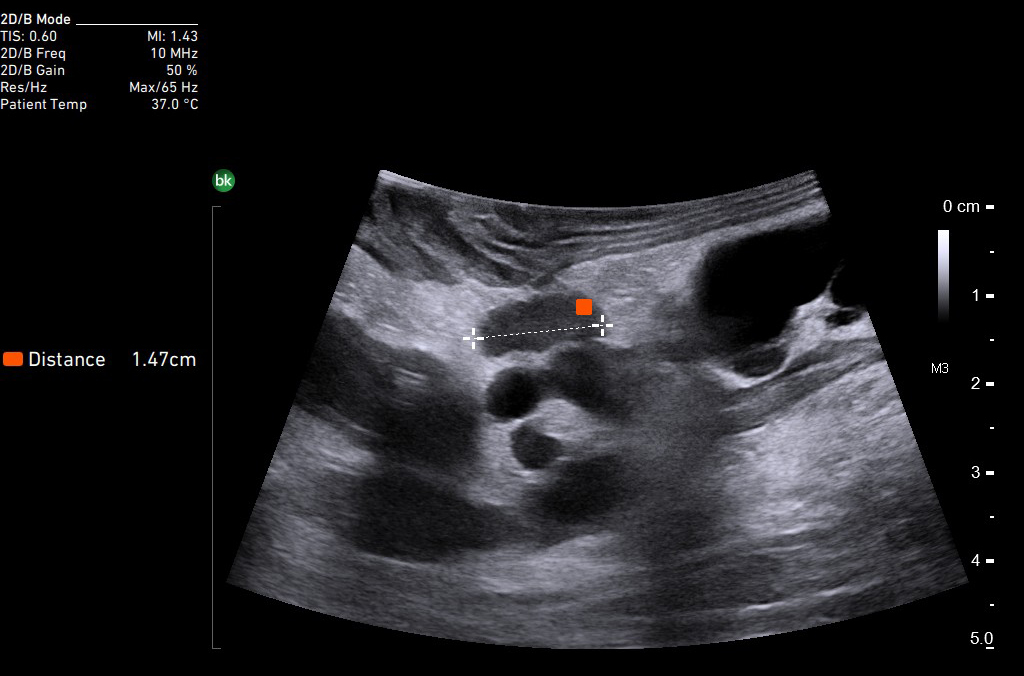
Урология
Органосохраняющие операции при образованиях почек должны сочетать в себе минимальный объем для сохранения функции почек и онкологические принципы лечения. Для определения объема вмешательства во всем мире активно используют ИУОЗИ не только при открытых и лапараскопических, но и роботических операциях [30, 31]. Оценивают не только объем поражения ткани почки, но и распространение на почечные сосуды, а также нижнюю полую вену [32].
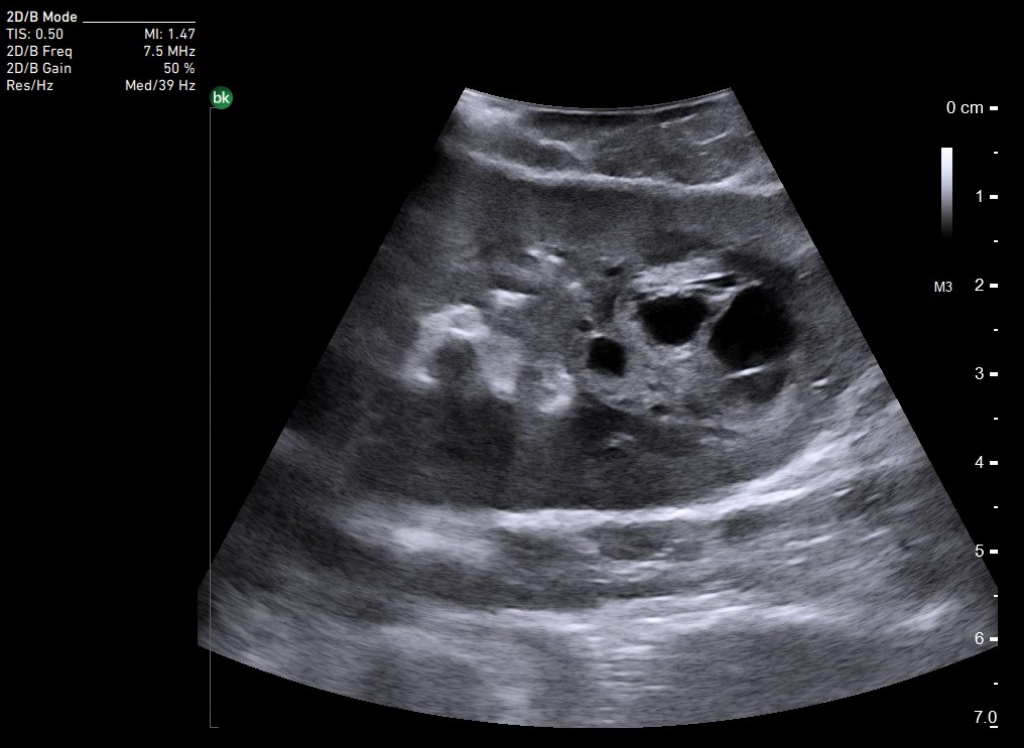
Методы локальной деструкции под ИОУЗ-навигацией
Ультразвуковой метод может быть использован в качестве навигации для диагностических пункций, биопсий, а также проведения локальной деструкции. В задачи ИУОЗИ входят локализация очага, определение взаимоотношения образования с окружающими тканями и крупными сосудами, а также определение наименее травматичный доступ к зоне интереса. Проводить пункцию образований можно методом «свободной» руки, который позволяет выбирать больше вариантов постановки датчика, есть возможность изменения траектории движения иглы и полипозиционной оценки. Для глубокорасположенных небольших образований лучше использовать специальные направляющие насадки для игл.
В качестве методов локальной деструкции наиболее широко применяется радиочастотная абляция и микроволновая абляция объемных образований, выполняемая под ультразвуковым контролем, как на этапе позиционирования иглы, так и в ходе выполнения термообработки за оценкой происходящих изменений. Наиболее затруднительным аспектом при оценке ультразвуковой картины в динамике и последующей трактовки наличия резидуальных фрагментов является «газовое облако», представленное пузырьками воздуха, появляющимися в процессе нагревания.
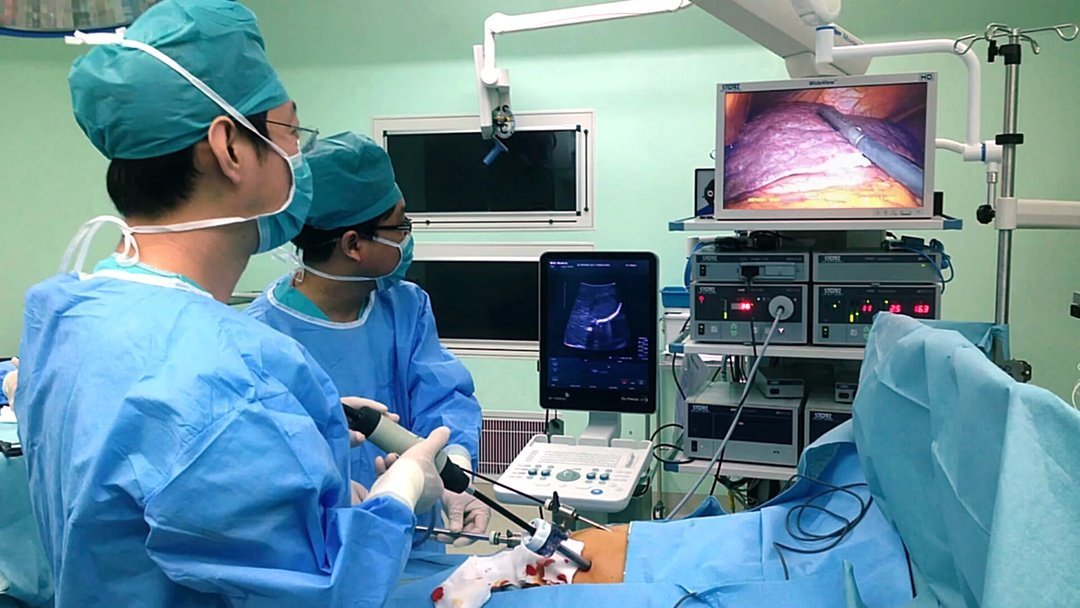
Метод локальной криодеструкции в последние годы стал активно применяться, особенно в нейрохирургии. Непосредственно на ткань опухоли устанавливается аппликатор или в опухоль вводится криозонд, происходит охлаждение до -180ºС на протяжении 3-5 минут. За это время при УЗИ видим формирование так называемого «ice ball», гиперэхогенная округлая структура с четким наружным контуром, дающая широкую акустическую тень. В период оттаивания наружный контур «ice ball» становиться неровным, зазубренным, приобретает вид «талого снега». Методика криодеструкции отличается тем, что не воздействует на сосудистые структуры, что подтверждается при ЦДК.
Заключение
Интраоперационное ультразвуковое исследование используется в качестве навигации и уточнения локализации объектов, для поиска непальпируемых очагов, оценки распространенности опухолевого процесса, проведения постоянного контроля за манипуляциями, уточнения радикальности выполненной операции и проходимость сосудистых реконструкций. Использование специализированной аппаратуры упрощает, повышает эффективность и сокращает время проведения исследования. При этом тандем хирурга и врача ультразвуковой диагностики помогает в минимально короткое время провести полноценное исследование и ответить на все возникающие в ходе операции вопросы.
- French L.A., Wild J.J., Neal D. The experimental application of ultrasonics to the localization of brain tumors. //J. Neurosurg. – 1951. - №8. – Р. 198–203. doi: 10.3171/jns.1951.8.2.0198.
- Knight P.R., Newell J.A. Operative use of ultrasonics in cholelithiasis. Lancet. 1963 May 11;1(7289):1023-5. doi: 10.1016/s0140-6736(63)92427-9.
- Schlegel J.U., Diggdon P., Cuellar J. The use of ultrasound for localizing renal calculi. J Urol. 1961. Jan; 53:43-54. doi: 10.1016/s0022-5347(17)65180-2
- Makuuchi M., Hasegawa H., Yamazaki S. Intraoperative ultrasonic examination for hepatectomy. Ultrasound Med Biol. 1983; Suppl 2:493-7. PMID: 6100712
- Chandler W.F., Knake J.E., McGillicuddy J.E. et al. Intraoperative use of real-time ultrasonography in neurosurgery. //J Neurosurg. – 1982. - №57. – Р. 157-163. doi: 10.3171/jns.1982.57.2.0157.
- Sigel B., Coelho J.C., Flanigan D.P. et al. Detection of vascular defects during operation by imaging ultrasound. Ann Surg. 1982 Oct;196(4):473-80. doi: 10.1097/00000658-198210000-00011.
- Sigel B., Machi J., Beitler J.C. et al. Operative ultrasonography of pancreatic and biliary pathology. Ann Radiol (Paris). 1982 Dec;25(8):547-50. PMID: 6820619
- Coelho J.C., Sigel B., Flanigan D.P. et al. Intraoperative use of ultrasonography for the detection of vascular defects]. Intraoperative use of ultrasonography for the detection of vascular defects. AMB Rev Assoc Med Bras. 1983 Mar-Apr; 29(3-4):71-3. PMID: 6605563
- Takamoto S., Kyo S., Adachi H. et al. Intraoperative color flow mapping by real-time two-dimensional Doppler echocardiography for evaluation of valvular and congenital heart disease and vascular disease. Thorac Cardiovasc Surg. 1985 Dec; 90(6):802-12. PMID: 4068730
- Ohta Y., Fujiwara K., Sato Y. et al. New ultrasonic laparoscope for diagnosis of intraabdominal diseases. Gastrointest Endosc. 1983 Nov;29(4):289-94. doi: 10.1016/s0016-5107(83)72635-0.
- Pino M.A., Imperato A., Musca I. et al. New Hope in Brain Glioma Surgery: The Role of Intraoperative Ultrasound. A Review Brain Sci. 2018 Nov 19;8(11):202. doi: 10.3390/brainsci8110202.
- Giammalva G.R., Iacopino D.G., Azzarello G., et al. End-of-Life Care in High-Grade Glioma Patients. The Palliative and Supportive Perspective. Brain Sci. 2018;8:125. doi: 10.3390/brainsci8070125.
- Gerard I., Kersten-Oertel M., Petrecca K., et al. Brain shift in neuronavigation of brain tumors: A review. Med. Image Anal. 2017;35:403–420. doi: 10.1016/j.media.2016.08.007.
- Сандриков В.А., Фисенко Е.П., Ветшева Н.Н. с соавт. Интраоперационное ультразвуковое исследование головного и спинного мозга. М., СТРОМ, 2012, 128 с.
- Del Bene M., Perin A., Casali C. et al. Advanced Ultrasound Imaging in Glioma Surgery: Beyond Gray-Scale B-mode. Oncol. 2018 Dec 3;8:576. doi: 10.3389/fonc.2018.00576.
- Mahboob S., McPhillips R., Qiu Z., et al. Intraoperative Ultrasound-Guided Resection of Gliomas: A Meta-Analysis and Review of the Literature. Eljamel S.World Neurosurg. 2016 Aug;92:255-263. doi: 10.1016/j.wneu.2016.05.007.
- Ветшева Н.Н., Васильев С.А., Фисенко Е.П. c соавт. Интраоперационная ультразвуковая оценка радикальности удаления объемных образований головного мозга/ Вестник Национального медико-хирургического центра им. Н.И. Пирогова. 2011. Т. 6. № 1. С. 104-108.
- Hou Y.L., Wang Y.D., Guo H.Q. et al. Ultrasound Location of Pulmonary Nodules in Video-Assisted Thoracoscopic Surgery for Precise Sublobectomy. Thorac Cancer . 2020 May;11(5):1354-1360. doi: 10.1111/1759-7714.13384.
- Hashimoto M., Tanaka F., Yoneda K. et al. Significant increase in circulating tumour cells in pulmonary venous blood during surgical manipulation in patients with primary lung cancer. Interact Cardiovasc Thorac Surg 2014; 18 (6): 775– 83.
- Тюлюсов А.М., Королёв Д.Г., Наймарк А.Н., Результаты применения интраоперационного узи при торакоскопических операциях " Аспирантский вестник Поволжья. 2015.
- Damian C.D., Rednic N., Munteanu D. et al. The role of intraoperative ultrasound for the assessment of the focal liver lesions in patients with colorectal cancer Med Ultrason 2014 Jun;16(2):114-8. doi: 10.11152/mu.201.3.2066.162.cdd1nr2.
- Прозорова Э.В., Казакевич В.И., Сидоров Д.В. с соавт. Роль интраоперационного ультразвукового исследования в стадировании солидных опухолей поджелудочной железы. Современные технологии в медицине. 2014. Т. 6. № 2. С. 68-76.
- Ветшева Н.Н. Инструментальная диагностика солидных опухолей поджелудочной железы Автореферат дисс. на соиск. уч. ст. доктора медицинских наук / Российский научный центр хирургии им. Акад. Б.В. Петровского. Москва, 2017.
- Okabayashi T., Shima Y., Sumiyoshi T. et al. Diagnosis and management of insulinoma. World J Gastroenterol 2013 February 14; 19(6): 829-837. doi: 10.3748/wjg.v19.i6.829.
- Кармазановский Г.Г., Ветшева Н.Н., Карельская Н.А. с соавт. Лучевая диагностика инсулином и незидиобластоза при синдроме органического гиперинсулинизма. Лучевая диагностика и терапия. 2016. № 3 (7). С. 53-60.
- Egorov V.I. Yashina N.I., Zhurenkova T.V. et al. Spleen-preserving distal pancreatectomy with resection of the splenic vessels. Should one rely on the short gastric arteries? JOP. 2011 Sep 9;12(5):445-57. PMID: 21904069
- Tran B.N., Celestin A.R., Lee B.T. et al. Quantifying Lymph Nodes During Lymph Node Transplantation: The Role of Intraoperative Ultrasound. Plast Surg. 2018 Dec;81(6):675-678. doi: 10.1097/SAP.0000000000001571.
- De Blasis I., Tortorella L., Macchi C. et al. Intraoperative ultrasound diagnosis of metastatic lymph node in serous borderline ovarian tumor. Ultrasound Obstet Gynecol. 2019, Oct;54(4):562-563. doi: 10.1002/uog.20234.
- Konno H., Minamiya Y. Lymph Node Diagnosis for Lung Cancer Kyobu Geka 2018 Sep;71(10):875-879. PMID: 30310042
- Di Cosmo G., Verzotti E., Silvestri T. et al. Intraoperative ultrasound in robot-assisted partial nephrectomy: State of the art. Ital Urol Androl. 2018 Sep 30;90(3):195-198. doi: 10.4081/aiua.2018.3.195.
- Каприн А.Д., Степанов С.О., Воробьев Н.В., Костин А.А., Димитров В.О. Возможности методов ультразвуковой диагностики при органосохраняющем лечении рака почки. Онкология. Журнал им. П.А. Герцена. 2019. Т. 8. № 1. С. 71-75.
- Li Q., Li N., Luo Y. et al. Role of intraoperative ultrasound in robotic-assisted radical nephrectomy with inferior vena cava thrombectomy in renal cell carcinoma. World J Urol. 2020 Dec;38(12):3191-3198. doi: 10.1007/s00345-020-03141-y.